近日,好意思国哈佛大学团队研发出一种使用 CMOS 工艺制造的微孔电极阵列,其能用于并行细胞内记载,从而用于突触运动映射。当将这一阵列和微孔-神经元接口以及电流钳电子器件集会通盘,能在大鼠神经元培养中完毕 90% 的平均细胞内耦合率,从而粗略生成包含丰富突触信号的细胞内记载数据。(注:CMOS 的英文是 complementary metal-oxide semiconductor,汉文翻译为互补金属氧化物半导体)。
(来源:Nature Biomedical Engineering)
从这些数据中,商酌东谈主员索要出 2000 多个神经元中的 70000 多个合理的突触运动,总体舛错率大致为 5%。关于体外大鼠神经元,CMOS 微孔阵列平均完毕了 90% 的细胞内耦合率,在最佳的情况下为 97%,平均细胞内记载振幅和细胞内耦合执续时候大致是此前要道的五倍。
同期,它还不错在换取的神经元上收复细胞内耦合,而接受更具侵入性的传统纳米针阵列则很难完毕这一遵守。这种映射限制远远突出了任何其他电极期间粗略完毕的限制。要知谈 CMOS 纳米针阵列只可画图大致 300 个突触运动的,而低通量膜片钳和突触不敏锐的微电极阵列的遵守更差。
与此同期,本次 CMOS 微孔电极阵列的可用性和性能均优于 CMOS 纳米针阵列,它能将并行细胞内记载变得浅易易用,况且仍能完毕强大的突触运动映射。
另外,它的微孔不仅愈加容易制造,还不错平凡使用。总的来说,这种限制的突触运动性画图以及表征突触运动的才能,让东谈主类朝着大限制神经元相聚的功能运动性画图迈出了新的一步。
日前,关连论文以《通过微孔电极阵列的并行化细胞内记载来映射数千个神经元之间的突触运动》(Synaptic connectivity mapping among thousands of neurons via parallelized intracellular recording with a microhole electrode array)为题发在 Nature Biomedical Engineering(IF 26.8)。

图 | 关连论文(来源:Nature Biomedical Engineering)
哈佛大学 Jun Wang 是第一作家,哈佛大学朴洪坤(Hongkun Park)讲授和韩德熙(Donhee Ham)讲授担任共同通信作家 [1]。

图 | 韩德熙(Donhee Ham)(来源:贵府图)

突触运动映射的需求仍未得到知足
弥远以来,电极一直是了解神经元偏激相聚的窗口。一方面,膜片钳电极具有细胞内记载功能,不错高智谋度地测量从一个到几个神经元的小突触信号。
另一方面,微电极阵列(MEA,micro electrode array)不错在细胞外并行记载很多神经元,关联词它关于突触信号衰败敏锐性。
在微电极阵列访佛的并行性条目下完毕访佛膜片钳的细胞内智谋度,可能为不雅察和探究神经相聚会无数突触信号开启一扇新窗口,有助于画图出该相聚的突触运动图并明确其运动强度特征,这亦然神经科学规模弥远以来的一个商酌课题。
因此,细胞内神经元记载的并行化一直是规模内所力图完毕的方向。关联词,事实解说它稀罕具有挑战性。关于各式类型的非膜片钳电极来说,就算使用单个神经元,也很难真确地检测突触信号的细胞内记载。
2020 年,该团队通过在具有 4096 个记载位点或像素的 CMOS 电子芯片上开采垂直纳米针电极阵列,借此在并行细胞内神经元记载上取得了显贵进展。
在使用电流钳同期进行电流注入和电压记载操作中,由 CMOS 电路操控的纳米针电极完毕了细胞内记载,从而能在单个像素上检测到突触信号,况且该阵列粗略赞助并行操作。
其时,商酌东谈主员发当今最佳的情况下,其能在 4096 像素的细胞内记载 1728 个体外大鼠神经元中,并借此发现了 304 个突触运动。而膜片钳只可在细胞内记载一到几个神经元,因此这远远超出了膜片钳的才能范围。
尽管这一进展意思环节,关联词这种 CMOS 纳米针阵列既不具备平方使用的便利性,也不具备并行细胞内记载的畅达性。由于纳米针的制造过于弯曲,因此无法平凡应用,而且其时这一设置仅能完毕 5.8% 的平均细胞内耦合率。诚然其性能是其时开始进的,但仍然远远不行知足突触运动映射的需求。基于此,商酌东谈主员开展了本次商酌。
(来源:Nature Biomedical Engineering)

六个单孔芯片的平均细胞内耦合率为 58%
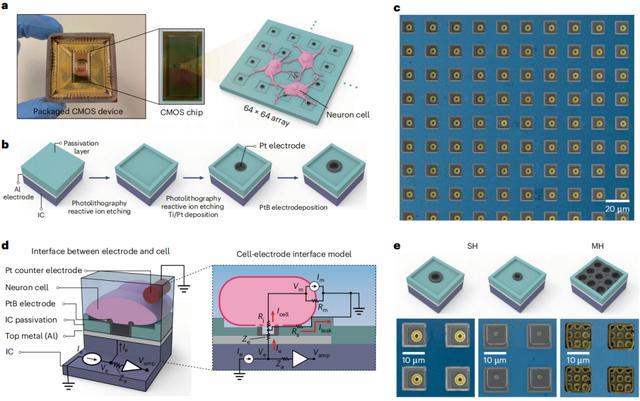
在本次商酌中,商酌东谈主员由代工场制造了这款 CMOS 芯片,在其名义上具有 64×64=4096 个铝像素焊盘,每个铝焊盘用 2.6µm 厚的 SiO2/Si3N4 钝化。
为了在每个焊盘上制造微孔电极,商酌东谈主员在钝化层中蚀刻一个 1.2µm 深、10×10µm² 宽的阱,在阱中心蚀刻一个 1.4µm 深的孔,以便露出底下的铝金属,并能针对 Pt/Ti 进行千里积。同期,他们在铂名义的孔上电千里积铂黑(PtB,platinum black),以便加多电极的名义野蛮度,进而加多其名义积和电导率。
商酌东谈主员示意,这种微孔电极的制造比垂直纳米针电极的制造浅易得多。同期,单个神经元就能针对微孔完毕统统粉饰,这能减少为了启动和保管细胞内记载所需的膜通透性电流打针量。
除了偶尔的脉冲除外,微孔阵列每像素注入的电流大小,平均比纳米针阵列大致减少五分之四。这些减少的电流不仅粗略减缓电极的劣化,炒白银而且由于关于电解质形成的化学扰动较小,因此所产生的气泡也较少,同期还能减少关于细胞的骚动。这在很猛进度上解释了微孔阵列细胞内耦合执续时候和速度粗略得到大幅扶植的原因,也解释了其再行赢得细胞内耦合才能的原因。
同期,商酌东谈主员还开采了每个像素具有短路多孔电极的器件。单孔芯片每像素电极散播较小,而多孔芯片的每像素电极散播较宽,因此不错算作单孔芯片的衬底。
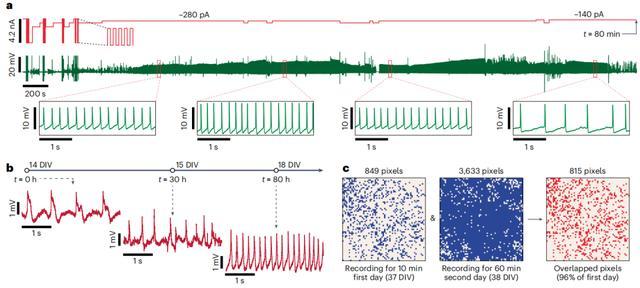
跟着向细胞内记载的升沉,动作电位呈现正极性,其振幅增长了一到两个数目级。执行中,商酌东谈主员发现了一些小的突触信号,比如突触后电位(PSP,postsynaptic potentials)和其他亚阈值事件。
尽管电流打针一直在执续进行,关联词细胞内信号最终依然在记载轨迹中丢失,商酌东谈主员将记载迹线中细胞内信号的丢失视为细胞内偶联的丢失。然后,他们将六个单孔芯片与体外大鼠神经元运动,并在无数像素下进行这种细胞内记载。
在前 20 分钟的运行中,六个单孔芯片的平均细胞内耦合率为 58%,这远远突出了纳米针阵列的平均值。总共执走运行时长突出 60 分钟,六个单孔芯片的细胞内偶联率平均达到 90%,最高达到 97%。
这六个单孔芯片的细胞内记载质料也优于纳米针阵列。细胞内记载的动作电位的平均幅度为 4.7 毫伏,细胞内耦合平均执续时候为 32 分钟。
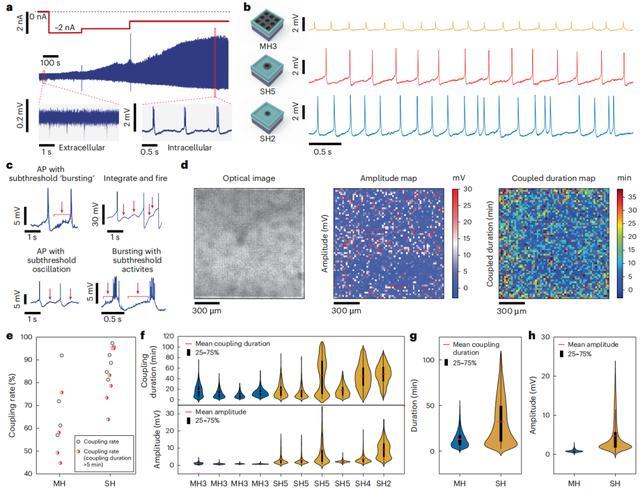
四个多孔芯片也王人顺利完毕了大限制并行细胞内记载,其平均细胞内偶联率为 71%,执续时候为 13 分钟,动作电位振幅为 0.9mV,这远远低于六个单孔芯片。
下图 b 比较了单个单孔像素和多孔像素的记载轨迹示例,而图 e-h 则针对六块单孔芯片和四块多孔芯片的细胞内耦合速度、执续时候和动作电位幅度进行了比较。这些甩手阐述了单孔芯片中小电极散播范围的平允。
(来源:Nature Biomedical Engineering)
意思的是,诚然多孔芯片在总共细胞内记载蓄意上平均不如单孔芯片,但前者每每阐扬出相对较少的芯片间互异,从而在耦合执续时候和幅度上阐扬出像素间的互异。
商酌东谈主员还进行了另一个对照执行,旨在展示孔嵌套孔电极的可能上风。为此,他们制备出另外三个单孔芯片,这些芯片的孔电极周围莫得诞生小阱。
完成制备之后,商酌东谈主员进行了三组全阵列范围的细胞内记载。在细胞内偶联位点总额和细胞内偶联强度等性能蓄意上,那些孔电极直径 d′=5 微米况且孔电极嵌套于小阱中的单孔芯片,每每要比对照组的单孔芯片有着更好的阐扬。
举例,前者的细胞内偶联强度平均约为两倍,这标明孔的存在不错扶植密封阻力。也等于说,与垂直纳米针电极比拟,嵌套在孔中的单孔电极的雠校,主要归因于单孔电极的小范围散播。
如前所述,单孔芯片的细胞内耦合执续时候的显贵改善,是由于单孔电极被神经元统统粉饰的可能性更高,因此电流钳所需的电流注入更小、侵入性更小。关联词,举座的小电流注入不是恒定的,而是变化的。
领先较大的电流有助于加快膜透性,以便快速赢得细胞内偶联。而随后较小的电流一方面用于保管赢得的透性从而保管细胞内偶联,另一方面用于减缓电极劣化。关联词,较大的运行电流不一定能保证细胞内耦合,稍后注入较小的电流可能会缓缓发生细胞内耦合。

AI 和神经样式筹画均可从本商酌受益
总的来说,大限制突触运动和运动强度的画图,不错使 AI 和神经样式筹画等商酌受益,并可能在筛选药物关于神经相聚的影响上找到生物医学应用。而本次由 CMOS 驱动的微孔电极阵列为这种突触运动映射提供了一条道路。一方面它易于操作,另一方面它粗略对神经相聚进行宏不雅细胞内记载。
通过在可插入大脑的三维绝缘棒阵列(而不是二维平面)上制造无数微孔电极,并将其应用于体内记载,不仅不错加多每个神经元发现的突触运动的平均数目,还不错将突触运动结构与相聚行动商酌起来。通过浅易地加多电极数目,不错进一步加多每个神经元发现的突触运动的数目。
诚然用于电流钳制的集成放大器和电流注入器的数目无法像电极数目那样很好地扩张,但不错应用开关矩阵期间,使用有限数目的有源电路来驱动更多的电极。不外,商酌东谈主员示意,这次展示的从全相聚细胞内记载数据画图突触运动的历程仅仅一个脱手,改日他们还将基于大数据开采愈加复杂的映射期间。
参考贵府:
1.Wang, J., Jung, WB., Gertner, R.S. et al. Synapaptic connectivity mapapping among thousands of neurons via parallelized intracellular recording with a microhole electrode array. Nat. Biomed. Eng (2025).https://doi.org/10.1038/s41551-025-01352-5
运营/排版:何晨龙